一、生物醫藥產業創新鏈
生物醫藥是以研發創新為核心的知識密集型產業,創新鏈可分為基礎研究、臨床前研究、臨床試驗、制造銷售等環節,藥物與器械間、不同藥物/器械間創新過程有所區別。在創新各環節過程中,藥監、科技等相關部門的審批監管是完成生物醫藥產業各個創新環節的重要節點,全流程審批監督也屬于創新鏈重要內容。因此,生物醫藥產業創新鏈包括基礎研究、臨床前研究、臨床試驗、產業化、全流程審批監督。具體參見圖1。
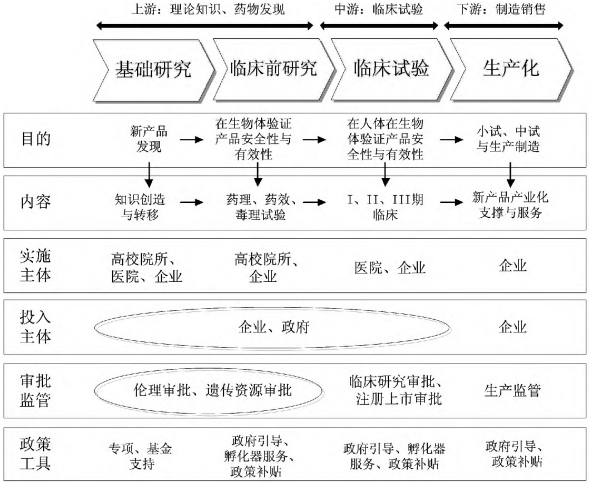
圖 1 生物醫藥創新流程
(一)基礎研究
基礎研究的目的是確定進入臨床前試驗的候選藥物,這一過程具體可分為靶標確定、模型建立、先導物發現、先導物優化4個階段。針對治療疾病及疾病相關靶點,利用多種途徑獲取相關物質,并通過計算機藥物分子設計、蛋白質水平檢測等方法,建立藥物模型以及篩選、評價藥物,找出具有藥理特性顯著的先導物。在發現先導物后,經過蛋白質改造、組合化學等方式處理,優化先導物的治療指數,形成結構類型新穎、藥效最佳的物質作為候選藥物。
(二)臨床前研究
臨床前研究指通過實驗室研究和動物實驗系統對候選藥物進行評價、分析研究及提純研究,通過對藥物的藥理、毒理、藥劑等研究,確定是否符合進入人體臨床試驗的條件。藥理研究探究藥物與機體間相互作用規律及藥物作用機制,包括藥效動力和藥代動力。毒理研究是研究藥物對生物體的毒性反應、嚴重程度、發生頻率和毒性作用機制,并對毒性作用進行定性和定量評價。藥劑研究指將藥物制成適宜的劑型及劑量。臨床前研究是藥物獲得臨床資格的必要前提,以自主研發、技術聯盟、轉讓許可、技術服務為主。
(三)臨床試驗
臨床試驗在人體進行藥物的系統性研究,目的是確定試驗藥物的療效與安全性,證實或揭示試驗藥物的作用、不良反應等。通過臨床前研究的藥物需要經過新藥臨床試驗申請才能進入臨床試驗。臨床試驗一般分為I、II、III、IV期臨床試驗和EAP臨床試驗,完成I、II、III期臨床試驗后,可向藥監部門提出新藥上市申請,獲得注冊上市批件即完成臨床試驗。臨床試驗一般由科研院所、臨床實驗醫院/基地、合同研究機構、醫院和患者等共同完成。
(四)產業化
產業化主要包括生產制造和銷售2個環節。生產造環節以獲批藥品注冊證/醫療器械注冊證為起點,將藥物發現和開發環節得到的創新成果依據市場需要進行加工,轉化為患者可以直接使用的最終藥品。醫療器械制造涉及產業鏈較長,需要材料、機械、電子元器件等基礎性行業作為支撐。銷售環節是價值鏈上的最后一個環節,生物醫藥產品銷售方式不同于其他商品,部分藥品器械的購買需憑醫生處方。同時,藥品器械的醫保采購、政府集中采購與普通商品的政府采購有所區別。
(五)全流程審批監督
審批監督貫穿生物醫藥產業各個創新環節。其中,生物醫學研究倫理審查、人類遺傳資源審批是開展生物醫藥產業基礎研究、臨床前研究、臨床試驗重點審批監管的內容,生物醫學研究倫理審查在我國由衛健部門負責,對涉及人的生物醫學研究均需要按照相關管理規定開展相關工作;人類遺傳資源管理在我國由科技部門負責。除一類、二類醫療器械除外,藥品器械開展臨床試驗前需要獲得臨床試驗批件;對藥品器械上市前需獲得注冊上市證書。生產制造方面,同樣需要藥監部門審批監督。
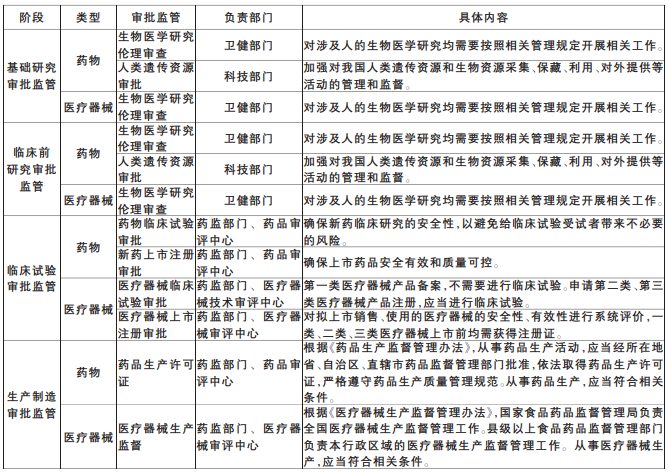
表1 藥物器械全流程審批監督情況
二、生物醫藥產業創新特點
(一)具有“四高一長”的創新發展特性
即高投入、高技術、高收益、高風險、長周期。其中,高投入表現在資金、人才、設備等方面的高投入。高技術表現在研究人員的高素質、產品高標準以及生產環境與設備的高要求。高收益表現為生物藥品高附加值特性能夠帶來高額利潤。雖然藥品器械需要大量研發資金,但成功研發的產品將在保護周期內處于壟斷地位,企業很快能收回成本并具有較大利潤空間。高風險表現為新藥研發本身面臨失敗的風險,主要源于藥品復雜的研發流程及較長開發周期,新產品研發成功率較低,生物技術藥開發的成功率約為5%~10%。長周期即需要很長的開發時間,國內新藥開發時間最快也需3~5年,國外一般需要8~10年,甚至更久。
(二)不同類別生物醫藥產品創新鏈各異
生物技術藥與化學藥創新流程大體相似,基礎研究環節的主要任務均為靶標確定、模型建立、先導物發現與優化;臨床前研究、臨床試驗流程、研究內容及審批監管機制大體一致,需完成后才能申請注冊上市。中醫藥發源于我國,自20世紀西醫傳入我國后,中醫藥借鑒了西醫的研究思路方法開展了大量研究,但對中藥理論本身的研究逐漸減少,從指導思想到具體研究方法、評價標準,中藥理論體系建設不完整。因此,目前中藥臨床前研究、臨床試驗評價標準有欠缺,學科理論及標準化建設正加速推進,部分以院內制劑、經典名方形式出現。醫療器械屬于多學科融合領域,雖然醫療器械創新流程與藥品大體相當,但也有所區別,其中,一類醫療器械產品注冊審批備案即可,不需進行臨床試驗。
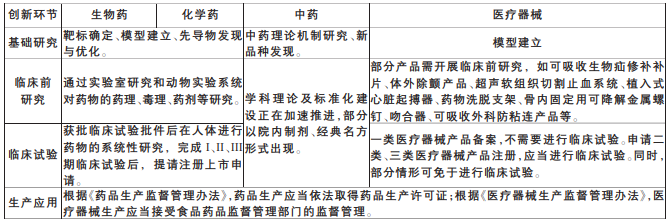
表2 藥物器械創新流程
(三)產業集聚創新發展特征明顯
生物醫藥產業研發周期長、投入高、風險大等特點致使單個企業難單獨完成研發全過程,對集群環境的依賴性成為生物醫藥產業創新的重要特征。生物醫藥產業對知識的依賴性很強,大學、科研機構、企業以及相關醫療機構在空間集聚,能夠有效推動知識在集聚區域的流通,大學科研機構開展基礎研究推動知識外溢,企業獲取最新知識推動技術創新,集聚發展也有利于不同主體開展協同合作、降低研發風險。美國波士頓、舊金山、圣地亞哥、華盛頓—巴爾的摩、北卡三角研究地帶等5大生物醫藥產業集聚區是產業集群發展的直觀表現。企業、人才的高度集聚推動“丹麥—瑞典”生物谷的成功建設。
(四)具有應對突發疾病科研攻關至關重要的支撐作用
歷史證明,重大公共衛生事件防御和應對離不開科學技術的支撐。新冠肺炎疫情發生以來,黨中央提出了臨床救治和藥物等五大主攻方向。要完成這五大主攻任務,必須要有生物醫藥產業創新體系作為支撐。生物醫藥產業創新體系在國家創新體系和治理體系中具有重要地位。新冠肺炎疫情使我們更加深刻認識到,構建重大疾病防控科研攻關體系,加強應急科研攻關能力建設,要與促進生物醫藥產業技術研發、企業創新、高層次人才、創新平臺建設、臨床審批監管機制優化等方面的創新發展緊密結合,構建支撐科研攻關的生物醫藥創新體系。
(五)重視生物安全及科研倫理
恪守科研倫理是科研工作者重要的社會責任。近年來,國家越來越重視生物醫學研究創新發展倫理建設能力提高,著力推動醫學科研工作的規范、有序開展,加強保護受試者權益的保護和人民生命的健康,促進科研創新的同時重視風險管理。2020年10月,我國通過了《中華人民共和國生物安全法》,以法定形式提出對生物倫理審查及人類遺傳資源監督管理的相關要求。與此同時,北京、上海、廣東等多地出臺相關政策,提出要加強生物醫學研究倫理建設。(作者:胡海鵬 袁永)
